Sykettä ja veren happikylläisyyttä mittaava pulssioksimetri yleistyy nopeasti aktiivisuusrannekkeissa ja terveydentilaa valvovissa älykelloissa. Happisaturaatiota mittaamalla voidaan paljastaa myös koronan aiheuttama salakavala ’hiljainen hypoksia’. Analog Devices on kehittänyt näihin mittauksiin valmiita moduuli- ja piiriratkaisuja, joiden avulla laadukas pulssioksimetri voidaan helposti lisätä mihin tahansa puettavaan laitteeseen.
Sykettä ja veren happikylläisyyttä mittaava pulssioksimetri yleistyy nopeasti aktiivisuusrannekkeissa ja terveydentilaa valvovissa älykelloissa. Happisaturaatiota mittaamalla voidaan paljastaa myös koronan aiheuttama salakavala ’hiljainen hypoksia’. Analog Devices on kehittänyt näihin mittauksiin valmiita moduuli- ja piiriratkaisuja, joiden avulla laadukas pulssioksimetri voidaan helposti lisätä mihin tahansa puettavaan laitteeseen.
|
Artikkelin kirjoittaja Robert Finnerty on järjestelmäsovellusinsinööri, joka työskentelee ADI:n Digital Healthcare Groupissa Limerickissä, Irlannissa. Hän tekee läheistä yhteistyötä Vital Signs Monitoring Groupin kanssa keskittyen optisiin ja impedanssin mittaukseen perustuviin ratkaisuihin. Rob liittyi ADI:n tarkkuusmuuntimien ryhmään vuonna 2012 ja on keskittynyt alhaisen kaistanleveyden tarkkuusmittauksiin. Hän on suorittanut insinöörin tutkinnon elektroniikassa ja sähkötekniikassa. |
Lääkinnällisistä laitteista yritetään suunnitella entistä helppokäyttöisiä ja vähemmän tehoa kuluttavia. Tässä artikkelissa käsitellään veren happikylläisyyttä määrittäviä SpO2-mittauksia ja osoitetaan, miten analogisten esiastepiirien (Analog Front End, AFE) uusi sukupolvi auttaa entistä parempien oksimetrilaitteiden kehittämisessä. Uusien piiriratkaisujen avulla mittauslaitteiden kehittämisessä voidaan päästä entistä helpompaan suunnitteluun ja yksinkertaisempaan mekaniikkaan sekä alhaisempaan tehonkulutukseen.
Veren happikylläisyyden eli happisaturaation (SpO2) määritys on mittaus, joka perinteisesti tehdään kehon ääreisosista kuten sormesta tai korvalehdestä. Yleisimmin tämä tehdään sormenpäähän pyykkipojan tapaan kiinnitettävällä klipsianturilla, joka mittaa happikylläisen hemoglobiinin määrän suhteessa kokonaishemoglobiiniin.
Mittaustulos kertoo, kuinka tehokkaasti punasolut kuljettavat happea keuhkoista muihin kehonosiin. Normaalisti SpO2-tasot vaihtelevat terveellä aikuisella 95-100 prosentin välillä. Tämän alueen alapuolella olevat tasot osoittavat hengityksen vajaustilaa, joka tunnetaan nimellä hypoksemia. Se tarkoittaa, ettei elimistö kykene kuljettamaan riittävästi happea ylläpitääkseen elinten terveyttä ja kognitiivisia toimintoja.
Hypoksemiasta kärsivä henkilö voi tuntea huimausta, sekavuutta, hengenahdistusta ja päänsärkyä. Useat eri sairaudet voivat aiheuttaa veren huonoa hapettumista ja täten vaatia jatkuvaa tai ajoittaista seurantaa kotona tai kliinisessä ympäristössä.
SpO2 on yksi yleisimmistä elintoimintojen mittauksista, joita kliinisissä olosuhteissa tehdään. Jatkuvaa SpO2-seurantaa vaativia tiloja ovat esimerkiksi astma, sydänsairaudet, keuhkoahtauma (COPD), keuhkosairaudet, keuhkokuume ja COVID-19:n aiheuttama hapenpuute (hypoksia).
Kun halutaan selvittää, tarvitseeko esimerkiksi oireellinen COVID-19-potilas sairaalahoitoa, yksi määritystapa on seurata hänen SpO2-tasoaan. Jos se jää alle normaalin perustason (yleensä alle 92 %), potilas tulee toimittaa sairaalahoitoon.
Yhteys COVID-19:n ja hypoksian välillä
Hiljattain koronapotilailta on diagnosoitu erityisen salakavala tila, joka tunnetaan nimellä hiljainen hypoksia. Se voi aiheuttaa elimistölle vakavaa vahinkoa ennen kuin potilaalle ilmaantuu mitään tyypillisiä COVID-19:n aiheuttamia hengitysoireita kuten hengenahdistusta. NCBI:n verkkosivuilla (National Center for Biotechnology Information) julkaistussa artikkelissa (ks. viite 1) todetaan, että ”kyky havaita tämä hiljainen hypoksian muoto COVID-19-potilailla, ennen kuin he alkavat kokea hengenahdistusta, on ratkaisevan tärkeä keuhkokuumeen etenemisen estämiseksi vaaralliselle tasolle”.
SpO2-seuranta on myös keskeinen indikaattori uniapnean diagnosoinnissa. Hengitystä vaikeuttava uniapnea syntyy hengitysteiden osittaisen tai täydellisen tukkeutumisen seurauksena unen aikana. Tämä voidaan havaita pitkinä hengityskatkoksina tai pinnallisena hengityksenä vain keuhkojen yläosia hyödyntäen. Tästä voi seurata tilapäinen hapenpuute eli hypoksiaa.
Ellei uniapneaa hoideta, se saattaa ajan myötä lisätä muun muassa sydänkohtauksen, aivohalvauksen ja verenpainetaudin todennäköisyyttä. Arvioiden mukaan eriasteista uniapneaa esiintyy noin 1-6 prosentilla koko aikuisväestöstä.
Parempaa pulssioksimetria kaivataan
Potilashoidon suuntaus kohti liikkuvaa ja kotona tapahtuvaa seurantaa on luonut tarpeen kehittää elintoimintojen seurantalaitteita, jotka eivät estä käyttäjiä suorittamasta päivittäisiä tehtäviään. SpO2-seurannan tapauksessa muualta kuin sormesta tai korvalehdestä tapahtuva happisaturaation mittaaminen tuo monenlaisia suunnitteluhaasteita. Äskettäin havaitun ns. hiljaisen hypoksian ilmaantuminen tekee kannettavien kliinisen tason pulssioksimetrien kehittämisestä entistäkin tärkeämpää.
Tässä artikkelissa selostetaan joitakin SpO2-mittausten perusperiaatteita ja esitellään ADI:n uusimman sukupolven optiset AFE-piirit ADPD4100 ja ADPD4101, jotka vähentävät lääketieteellisten SpO2-laitteiden suunnitteluun liittyvää monimutkaisuutta. Sisäänrakennettu automaattinen ympäristövalon vaimennus vähentää laitteen mekaniikan ja elektroniikan suunnittelijoiden työmäärää.
Pienivirtaisen ADPD4100-piirin laaja dynaaminen alue vähentää tarvittavien fotodiodien määrää ja ledien kuluttamaa virtaa, minkä ansiosta pienet vaihtelut potilaan SpO2-tasossa voidaan havaita hyvin energiatehokkaasti. Lisäksi piirin digitaalisen integroinnin vaihtoehdot mahdollistavat sen, että laite voi siirtyä erittäin niukasti tehoa kuluttavaan tilaan. Tämä mahdollistaa entistä pidemmät käyttöajat kannettaville PPG-laitteille (photoplethysmogram). Samalla perinteiset analogiset lohkot poistuvat optiselta signaalipolulta.
Mitä on happisaturaatio?
Veren happisaturaatiolla tarkoitetaan happikylläisen hemoglobiiniin prosenttiosuutta suhteessa käytettävissä olevaan veren kokonaishemoglobiiniin. Kaikkein tarkimmissa mittauksissa happisaturaatio määritetään mittaamalla sydämen eteisessä virtaavan veren happikylläisyys SaO2. Tämä menetelmä edellyttää kuitenkin verinäytteestä tehtävää verikaasuanalyysiä laboratoriossa. Kalibrointia koskevassa jaksossa tätä asiaa käsitellään tarkemmin.
Käytännössä SpO2-lukema on arvio happisaturaatiotasosta, joka mitataan kehon ääreisosista pulssioksimetrillä. Viime aikoihin asti yleisin tapa happisaturaation mittaamiseen on ollut sormeen kiinnitetyn pulssioksimetrin käyttäminen.
Kuinka pulssioksimetri toimii?
Pulssioksimetrin toiminta perustuu siihen, että hapetetussa hemoglobiinissa (HbO2) ja hapettomassa hemoglobiinissa (RHb) tapahtuvassa valon absorptiossa on merkittäviä eroja tietyillä aallonpituuksilla. Kuvassa 1 nähdään käyrät, jotka kuvaavat eri hemoglobiinimuotojen ns. ekstinktiokerrointa näkyvän valon ja infrapunavalon eri aallonpituuksilla: HbO2, Hb, ja MetHb (methemoglobiini).
Ekstinktiokerroin kuvaa sitä, kuinka voimakkaasti kemiallinen aine absorboi valoa tietyllä aallonpituudella. Kuvasta 1 nähdään, että HbO2 absorboi enemmän punaista valoa (600 nm) ja päästää vastaavasti lävitseen enemmän infarapunavaloa (940 nm). RHb puolestaan absorboi enemmän valoa infrapuna-alueella, ja punaista valoa pääsee läpi enemmän kuin HbO2:lla.
Perusrakenteinen pulssioksimetri koostuu kahdesta ledistä (punainen 660 nm ja infrapuna 940 nm) ja yhdestä fotodiodista (PD) heijastavassa tai läpäisevässä kokoonpanossa (kuva 4). Pulssioksimetri syöttää pulssimuotoista virtaa punaiselle ledille ja mittaa tuloksena saatavan signaalin fotodiodin avulla. Sen jälkeen sama toistetaan IR-ledille ja lopuksi vielä molemmille niiden ollessa sammutettuina, jolloin saadaan pohjataso ympäristöstä tuleville ulkopuolisille valolähteille. Tuloksena saadaan fotopletysmografinen signaali (PPG) molemmille aallonpituuksille.
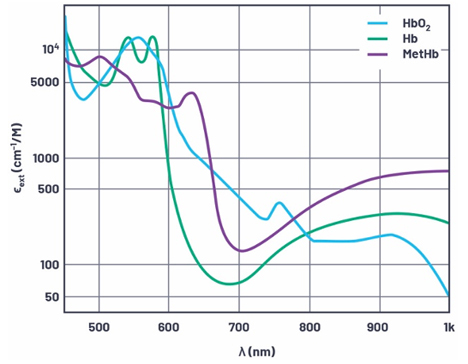
Kuva 1. Valon ekstinktiokerrointa kuvaavat käyrät eri hemoglobiinimuodoilla ja eri aallonpituuksilla.
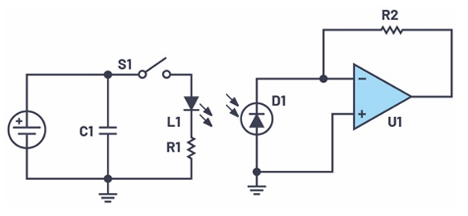
Kuva 2. Perusrakenteisen pulssioksimetrin piirikaavio.
Mitatussa signaalissa on sekä DC- että AC-komponenteista. DC-komponentti johtuu jatkuvasti heijastavista kudoksista kuten ihosta, lihaksista, luusta ja laskimoverestä. Kun keho on levossa, eikä liikkeillä ole juuri merkitystä, AC-komponentti syntyy pääasiassa sykkivän valtimoveren heijastamasta valosta. AC-komponentin suuruus riippuu syketasosta ja valtimon seinämän paksuudesta: systolisessa vaiheessa (pumppaus) heijastuvaa tai läpäisevää valoa havaitaan eri määrä kuin sydämen diastolisessa vaiheessa (lepojakso).
Systolisessa vaiheessa sydän pumppaa verta, jolloin verenpaine valtimoissa nousee. Verenpaineen nousu puolestaan laajentaa valtimoita ja johtaa niissä olevan veren tilavuuden kasvuun. Verimäärän lisääntyminen lisää valon absorptiota. Verenpaine vuorostaan laskee diastolisen vaiheen aikana ja sen seurauksena myös valon absorptio vähenee. Kuvassa 3 nähdään veren alapainetaso diastolisessa vaiheessa ja sykkivän sydämen aiheuttamat painehuiput systolisessa vaiheessa.
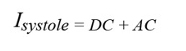
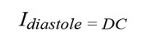
Beer-Lambertin lain mukaan valo vaimenee eksponentiaalisesti kulkiessaan absorboivan materiaalin läpi. Tätä voidaan hyödyntää määrittämään hapettuneen hemoglobiinin taso suhteessa kokonaishemoglobiiniin.
Diastolisessa ja systolisessa vaiheessa absorboituneen valon intensiteettien suhde määräytyy seuraavasti:
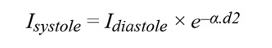
missä α kuvaa valon absorptiota eteisveressä ja d2 on PPG-signaalin AC-amplitudi (kuva 3). Idiastole on yhtä suuri kuin DC-komponentti, joka on merkitty d1.
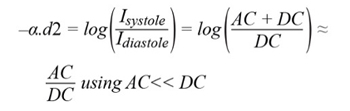
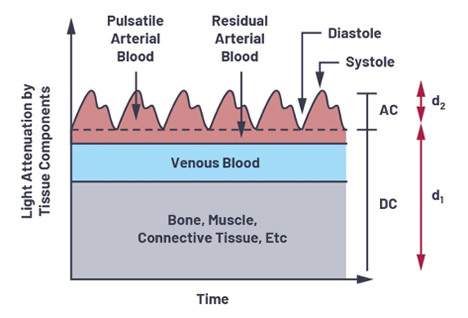
Kuva 3. Valon vaimeneminen eri kudosten läpi.
Laskemalla AC- ja DC-komponentit PPG-signaalista voidaan määrittää sydämen eteisveren valoabsorption muutos –α.d2, jonka aiheuttaa sydämen pumppaama veri ilman muiden kudosten vaikutusta.
AC-komponentin suhdetta DC-komponenttiin kutsutaan perfuusioindeksiksi PI, joka tarkoittaa sykkivän verivirtauksen suhdetta ei-sykkivään staattiseen verivirtaukseen. PPG-pohjaisen syke- tai SpO2-mittausjärjestelmän tavoitteena on kasvattaa tätä AC/DC-signaalisuhdetta.
PI = AC/DC
Infrapuna- ja punaisen valon aallonpituuksien perfuusioindeksejä voidaan käyttää määrittämään suhteiden suhde (RoR), joka on PIred-suhteen suhde PiIR-suhteeseen. Valon absorptio tietyllä aallonpituudella on verrannollinen seuraavasti:
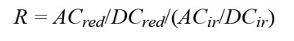
Teoriassa RoR voidaan SpO2:n laskemiseksi korvata seuraavalla kaavalla:
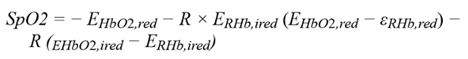
missä EHbO2,red = HbO2:n ekstinktiokerroin 600 nm aallonpituudella ja EHbO2,ired = HbO2:n ekstinktiokerroin 940 nm aallonpituudella sekä ERHb,ired = RHb:n ekstinktiokerroin 940 nm aallonpituudella ja ERHb,red = RHb:n ekstinktiokerroin 600 nm aallonpituudella.
Beer-Lambertin lakia ei kuitenkaan voida käyttää suoraan, koska jokaisessa optisessa laiterakenteessa esiintyy useita muuttuvia tekijöitä, jotka aiheuttavat vaihtelua RoR:n ja SpO2:n suhteen välillä. Näitä ovat rakenteen mekaaniset väliseinämät, ledien ja fotodiodien väliset etäisyydet, elektroniikan ja mekaniikan kyky vaimentaa ulkoista hajavaloa, fotodiodin vahvistusvirheet ja monet muut.
Kliinisen luokan tarkkuuden saavuttamiseksi PPG-pohjaiselle SpO2-pulssioksimetrille on luotava hakutaulukko tai algoritmi RoR:n ja SpO2:n välisen korrelaation määrittämiseksi.
Kalibrointi
Mittausjärjestelmän tulee olla kalibroitu, jotta voidaan kehittää riittävän tarkka SpO2-algoritmi. SpO2-järjestelmän kalibroimiseksi on tehtävä kliininen tutkimus, jossa osallistujien veren happitasoja alennetaan lääketieteellisin keinoin ja niitä seurataan lääkärin valvonnan alaisena. Tätä kutsutaan hypoksiatutkimukseksi.
SpO2-mittausjärjestelmä voi olla vain yhtä tarkka kuin käytetty referenssimittaus. Vertailutasot voidaan mitata klipsillä sormenpäähän kiinnitettävillä oksimetreillä tai korkeimman mittausluokan tuovilla ko-oksimetreillä. Ko-oksimetria on kehoon tunkeutuva eli invasiivinen menetelmä veren happisaturaation mittaamiseksi. Se tarjoaa huippuluokan tarkkuuden, mutta useimmissa tapauksissa sitä on hankala käyttää.
Kalibrointiprosessia käytetään parhaan sovituskäyrän luomiseksi RoR-arvolle, joka lasketaan optisesta SpO2-laitteesta verrattuna ko-oksimetrillä suoritettuun kehonsisäiseen SaO2-mittaukseen. Tätä käyrää hyväksi käyttäen laaditaan hakutaulukko tai yhtälö SpO2-arvon laskemista varten.
Kalibrointi vaaditaan kaikille kehitettäville SpO2-mittareille, koska RoR riippuu useista muuttujista kuten ledin aallonpituudesta ja intensiteetistä, fotodiodin vasteesta, mittauskohdasta keholla sekä ympäristön hajavalon vaimentamisesta. Kaikki nämä vaihtelevat suunnittelukohtaisesti.
Korkeampi perfuusioindeksi sekä siitä seuraava voimakkaampi AC-signaali punaisen ja IR-valon aallonpituuksilla lisäävät RoR-laskennan herkkyyttä ja parantavat siten SpO2-mittauksen tarkkuutta.
Hypoksiatutkimuksessa on kirjattava vähintään 200 mittausta tasaisin välein 100 – 70 prosentin välillä vaihtelevasta veren happisaturaatiosta. Mittauksiin tulee valita koehenkilöiksi riittävästi vaihtoehtoja ihonvärin, iän ja sukupuolen mukaan. Testihenkilöiden eroavuudet aiehuttavat hajontaa perfuusioindeksiin.
Kudoksen läpi valoa lähettävän transmissiivisen pulssioksimetrin kokonaisvirheen tulisi olla alle 3,0 prosenttia ja reflektiivisen eli heijastukseen perustuvan oksimetrin alle 3,5 prosenttia.
Läpäisevä vai heijastava mittaus?
PPG-signaali voidaan luoda käyttämällä joko läpäisevää tai heijastavaa konfiguraatiota ledien ja fotodiodien sijoittelussa. Transmissiivinen konfiguraatio mittaa kehonosan läpi kulkevaa absoboitumatonta valoa. Tämä kokoonpano sopii parhaiten sormen tai korvalehden kaltaisiin kehonosiin, joissa mittaus hyötyy suuresta kapillaaritiheydestä. Tämä tekee mittauksista vakaampia, toistettavampia ja vähemmän herkkiä sijoituskohteen vaihteluille. Transmissiiviset konfiguraatiot parantavat perfuusioindeksiä 40-60 dB.
Heijastava PPG-rakenne valitaan, kun ledi ja fotodiodi on sijoitettava käytännön syistä vierekkäin esimerkiksi rannekkeessa tai rintavyössä.
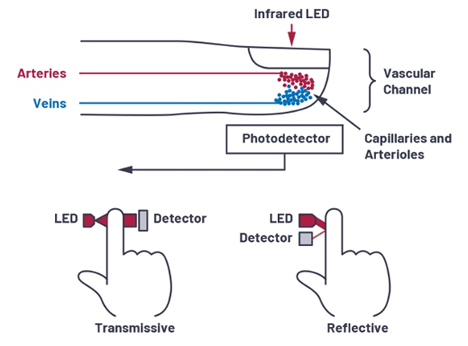
Kuva 4. Ledin ja valoanturin sijoittelu läpäisevässä ja heijastavassa mittauksessa.
Anturin sijainti ja perfuusioindeksi
Pulssioksimetrin sijoittaminen ranteeseen tai rintakehään vaatii PPG-laitteen AFE-lohkolta laajempaa dynaamista aluetta, koska DC-signaali kasvaa huomattavasti staattisten heijastavien osien (iho, rasva, luu) alapuolella syvällä olevien valtimoiden vuoksi.
PPG-mittauksen suurempi resoluutio vähentää epävarmuutta SpO2-algoritmissa. Tyypillinen PI-arvo ranteessa käytettäville SpO2-antureille on 1-2%, ja pulssioksimetrin suunnittelun tavoitteena on kasvattaa tätä PI-arvoa mekaanisen suunnittelun avulla tai laajentamalla järjestelmän dynamiikkaa.
Ledin etäisyydellä fotodiodista on suuri vaikutus PI-arvoon. Liian lyhyt väli lisää niiden välistä ylikuulumista tai takaisinsirontaa. Tämä ilmene DC-signaalina, joka voi yliohjata AFE-etuasteen.
Valolähteen ja anturin etäisyyden kasvattaminen vähentää sekä takaisinsironnan että ylikuulumisen vaikutusta, mutta pienentää myös virran muuntosuhdetta (CTR), joka on ledin lähdön ja fotodiodin palauttaman virran suhde. Tämä vaikuttaa PPG-järjestelmän hyötysuhteeseen ja vaatii suurempaa tehoa ledille AFE:n dynamiikan maksimoimiseksi.
Yhden tai useamman ledin nopealla pulssiteksella on se etu, että kokonaissignaalin 1/f-kohinaosuus vähenee. Ledien pulssitus mahdollistaa myös synkronisen moduloinnin käyttämisen vastaanottopuolella, mikä poistaa ympäristön hajavalon häiriön mittaustuloksesta. Useiden pulssien integrointi lisää PD-signaalin amplitudia ja alentaa keskimääräistä virrankulutusta. Fotodetektorin kokonaispinta-alan suurentaminen kasvattaa myös virran muuntosuhdetta, kun suurempi osa heijastuvan valon fotoneista saadaan pyydystettyä.
Monet sykemittarien (HR) valmistajat ovat ottaneet PPG-mittauksessa käyttöön yhden suurikikokoisen fotodiodin ja ryhmän energiatehokkaita vihreitä ledejä käytettäväksi kehonosissa, joissa verenkierto on rajallista. Vihreitä ledejä käytetään, koska ne rajoittavat voimakkaasti liikkeistä aiheutuvia artefakteja (ks. viite 2).
Tämä tapahtuu kuitenkin tehokulutuksen kustannuksella. Vihreällä ledillä on suurempi myötäjännite kuin punaisella ledillä tai IR-ledillä. Lisäksi vihreä valo absorptoituu voimakkaasti ihmiskudoksessa. Tämä tarkoittaa, että ledille pitää syttää enemmän tehoa, jotta sydämen ja verenkierron toiminnasta saadaan kerättyä merkityksekästä dataa.
Koska SpO2-mittaus vaatii useita aallonpituuksia ja useimmissa järjestelmissä on käytetään energiatehokkaita vihreitä ledejä HR PPG -mittausta varten, yleisin HR- ja SpO2 PPG -järjestelmien konfiguraatio on yhden vihreän ledin, yhden punaisen ledin ja yhden IR-ledin muodostama ryhmä, jota ympäröi useita fotodiodeja.
Tämä konfiguraatio on nähtävissä esimerkiksi Analog Devicesin suunnittelijoille tarjoaman ADI VSM -terveyskellon rakennetta esittävässä kuvassa 5. Kehitysvälineeksi tarkoitetussa laitteessa ledien ja fotodiodien etäisyydet on optimoitu vähentämään valon takaisinsirontaa, ja väliseinämien avulla luotu rakenne on suunniteltu vähentämään ylikuulumista niiden välillä.
Useita ADI VSM -älykellon prototyyppejä testattiin, jotta löydettiin tehokkain mahdollinen ledien ja fotodiodien etäisyys SpO2- ja HR PPG -mittauksia varten.
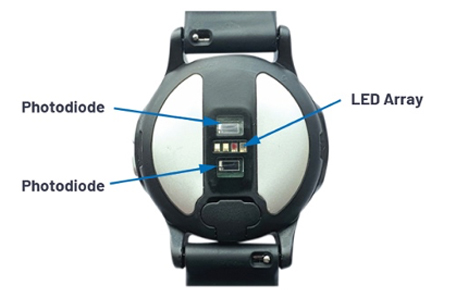
Kuva 5. Suunnittelijoiden avuksi tarkoitetussa ADI VSM V4 -terveyskellossa ledien ja fotodiodien sijoittelu sekä väliseinämien rakenne ovat tärkeitä suorituskyvyn kannalta.
Liikeartefaktit
Liikkeen aiheuttamat virhesignaalit eli artefaktit ovat yksi PPG-mittausjärjestelmän suunnittelun suurimmista haasteista. Kun liikettä esiintyy, valtimoiden ja laskimoiden läpimitta muuttuu paineen vaikutuksesta. Sen seurauksena fotodiodin absorboima valomäärä muuttuu ja tämä näkyy PPG-signaalissa, koska liikkeen aikana fotonit absorboituvat tai heijastuvat eri tavalla kuin kehon ollessa levossa.
Teoriassa äärettömän laajalla pinta-alalla toimivassa fotoilmaisimessa, joka kattaa äärettömän pitkän syväkudosnäytteen, kaikki fotonit heijastuvat lopulta ilmaisimeen, jolloin liikkeestä aiheutuvaa artefaktia ei havaittaisi. Tätä ei käytännössä voida kuitenkaan saavuttaa, joten ratkaisuna on kasvattaa fotodiodin todellista pinta-alaa ja ottaa myös kapasitanssi huomioon sekä alentaa AFE:n kohinaa ja tarjota mahdollisuus liikeartefaktien suodattamiseen.
PPG-signaalin taajuus on normaalisti välillä 0,5 – 5 Hz, kun taas liikeartefaktit ilmenevät tyypillisesti välillä 0,01 – 10 Hz. Yksinkertaisia kaistanpäästösuotimia ei siksi voida käyttää liikeartefaktien poistamiseen PPG-signaalista. Suuritarkkuuksinen liikkeen kompensointi vaatii adaptiivisen suotimen, jolle syötetään erittäin tarkkoja tietoja liiketilasta.
Analog Devices on kehittänyt tätä tarkoitusta varten 3-akselisen kiihtyvyysanturin ADXL362. Tämä kiihtyvyysanturi tarjoaa yhden mg:n resoluution jopa 8 g:n mittausalueella ja kuluttaa tehoa vain 3,6 mikrowattia 100 Hz näytteistystaajuudella. Anturi on saatavissa 3 x 3 millimetrin kotelossa.
ADI:n ratkaisu: ADPD4100
Pulssioksimetrin sijainti keholla tuottaa useita haasteita. Ranteessa pidettävät SpO2-laitteet tuovat vielä lisää haasteita suunnitteluun, koska kiinnostava AC-signaali on vain 1-2 % fotodiodin vastaanottaman valon kokonaismäärästä. Lääketieteellisen sertifikaatin saavuttamiseksi ja oksihemoglobiinitasojen pienten tasonvaihtelujen havaitsemiseksi tarvitaan AC-signaalille tavallista suurempi dynaaminen alue. Tämä voidaan saavuttaa vähentämällä ympäristöstä tulevan hajavalon aiheuttamia häiriöitä ja vähentämällä sekä lediohjainten että AFE:n kohinaa. ADI on ratkaissut tämän ongelman piirillä ADPD4100.
ADPD4100 ja ADPD41001 saavuttavat jopa 100 dB signaali-kohinasuhteen. Tämä laajennettu dynaaminen alue on välttämätön SpO2:n mittaamiseksi alhaisen perfuusion skenaariossa. Integroidussa optisessa AFE-lohkossa on kahdeksan pienikohinaista virtalähdettä ja kahdeksan erillistä PD-tuloa fotodiodeja varten. Digitaalisessa ajoitusten ohjainlohkossa on 12 ohjelmoitavaa aikaväliä (time slot), joiden avulla käyttäjä voi määrittää ledeille ja fotodiodeille joukon sekvenssejä halutuilla ledivirroilla, analogisella ja digitaalisella suodatuksella, integrointivaihtoehdoilla ja ajoitusraja-arvoilla.
ADPD4100-piirin tärkein etu on entistä parempi signaali-kohinasuhde mikrowattia kohti (SNR/μW), joka on tärkeä parametri jatkuvassa akkukäyttöisessä monitoroinnissa. Tämä keskeinen ominaisuus on saavutettu laajentamalla AFE:n dynaamista aluetta ja samalla alentamalla sen virrankulutusta. ADPD4100:n kokonaistehonkulutus on vain 30 μW jatkuvassa 75 dB / 25 Hz PPG-mittauksessa ledin syöttöteho mukaan luettuna.
Pulssien lukumäärän lisääminen näytettä kohti (n) kasvattaa S/N-suhteen verrannollisena neliöjuureeen (√n), kun taas ledin syöttövirran kasvattaminen kasvattaa SNR-lukemaa suoraan verrannollisesti. Yhden mikrowatin kokonaiskulutuksella järjestelmä saavuttaa jatkuvassa PPG-mittauksessa 93 dB signaali-kohinasuhteen 4 voltin ledikäyttöjännitteellä.
Ympäristön hajavalon automaattinen vaimennus vähentää isäntäprosessorin kuormitusta ja auttaa yltämään 60 desibelin valonvaimennukseen. Tämä saavutetaan käyttämällä jopa vain yhden mikrosekunnin pituisia ledipulsseja kaistanpäästösuotimen kera häiriöiden torjumiseksi. Tietyissä toimintamuodoissa ADPD4100-piiri laskee automaattisesti fotodiodin pimeävirran tai ledin off-tilan virran. Tämä vähennetään ledin on-tilan virrasta ennen muuntamista piirin AD-muunnosta ympäristövalon poistamiseksi sekä fotodiodin vahvistusvirheiden ja ryöminnän eliminoimiseksi.
ADPD4100-piirin tueksi ADI tarjoaa evaluointisarjalla EVAL-ADPD4100-4101 ja älykellokonseptia ADI Vital Signs Monitoring Study Watch. Nämä laitteet kytkeytyvät saumattomasti ADI:n Wavetool-sovellukseen bioimpedanssin, EKG:n, PPG-sykemittausten ja useilla aallonpituuksilla tapahtuvien PPG-mittausten mahdollistamiseksi SpO2-kehitystyötä varten.
Kehitysvälineeksi tarkoitettuun ADI:n terveyskelloon on sulautettu automaattinen vahvistuksen säätöalgoritmi (AGC) ADPD4001-piirille. Se säätää suunniteltavan laitteen TIA-vahvistusta (transimpedance amplifier) ja ledivirtaa pyrkien tuottamaan optimaalisen AC-signaalin dynamiikka-alueen kaikille valituille ledien aallonpituuksille.
Vaihtoehtoisia ratkaisuja
Sormenpäästä tai korvalehdestä tehtävät läpivalaisevat SpO2-mittaukset ovat helpoimpia suunnitella, koska signaali-kohinasuhde on silloin korkeampi kuin ranteeseen tai rintakehään sijoitetuilla mittauksilla. Tämä johtuu siitä, että mittauskohdassa on vähemmän lihas- ja luukudosta, mikä myös vähentää DC-komponentin osuutta.
Tällaisiin sovelluksiin moduuli ADPD144RI ja piiri ADPD1080 ovat sopivia ratkaisuja.
ADPD144RI on valmis moduuliratkaisu, johon on integroitu punainen 660 nm ledi ja 880 nm IR-ledi sekä neljä fotodiodia pakattuina 2,8 x 5 millin koteloon. Ledien ja fotodiodien välinen etäisyys on optimoitu antamaan paras signaali-kohinasuhde SpO2-tason tarkkoihin PPG-mittauksiin.
Moduulin avulla suunnittelija voi nopeasti ohittaa ledien ja fotodiodin sijoitteluun ja etäisyyksiin liittyvät suunnitteluhaasteet ja saavuttaa optimaalisen teho-kohinasuhteen. ADPD144RI on mekaanisesti optimoitu vähentämään optista ylikuulumista niin paljon kuin mahdollista. Se tarjoaa vakaan ratkaisun jopa silloin, kun anturi on sijoitettu lasi-ikkunan alle.
APDP1080-piiri on puolestaan integroitu optinen AFE-etuaste, jossa on kolme lediohjauskanavaa ja kaksi PD-tulokanavaa fotodiodeille pakattuina 17-nystyiseen 2,5 x 1,4 millin WLLCSP-koteloon. Tämä AFE-piiri on ihanteellinen ratkaisu räätälöityihin pienikanavaisiin PPG-tuotteisiin, joiden käytettävissä oleva piirilevyala on kriittinen tekijä.
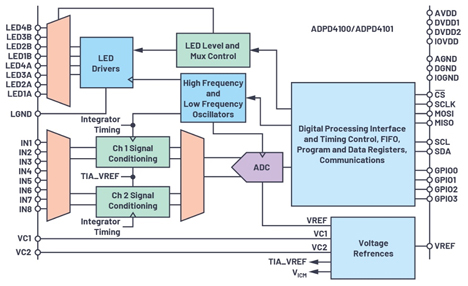
Kuva 6. ADPD410X-piirin lohkokaavio.
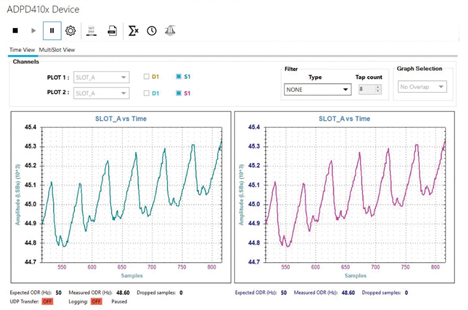
Kuva 7. ADPD4100-piirin avulla samanaikaisesti tehty PPG-mittaus punaisella ledillä (oikea) ja IR-ledillä (vasen).
Viitteet
1) Toshiyo Tamura. “Current Progress of Photoplethysmography and SpO2 for Health Monitoring.” Biomedical Engineering Letters, February 2019.
2) Jihyoung Lee, Kenta Matsumura, Ken-Ichi Yamakoshi, Peter Rolfe, Shinobu Tanaka ja Takehiro Yamakoshi. “Comparison Between Red Green and Blue Light Reflection Photoplethysmography for Heart Rate Monitoring During Motion.” 2013 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC), July 2013.